24836Views 0Comments
Comprender la cinética del oxígeno, los principales trastornos fisiológicos que se producen durante el shock, las respuestas del huésped a la mala perfusión, las formas de diagnosticar y revertir los estados de shock pueden mejorar el resultado de los pacientes lesionados y en estado crítico.
El manejo del paciente en estado de shock ha sido parte integral de la experiencia del cirujano durante siglos. En 1854, el fisiólogo francés Claude Bernard sugirió que los organismos intentan mantener la constancia en el ambiente interno a pesar de las fuerzas externas que intentan perturbarlo; esta idea fue refinada más adelante en el concepto de homeostasis por el Dr. Walter Bradford Cannon. En animales intactos, la falla de los sistemas fisiológicos para amortiguar el organismo contra estas fuerzas externas y mantener la homeostasis produce el estado de shock. Prueba de ello es que los análisis seriados de la respuesta genómica a una lesión grave identificaron que los pacientes capaces de restaurar la homeostasis con mayor rapidez tienen los mejores resultados.
El Dr. Alfred Blalock describió una asociación entre el shock después de una hemorragia y la reducción del gasto cardíaco y declaró que el shock hemorrágico era el resultado de la pérdida de volumen, no solo de «factores tóxicos». El concepto de que el shock hemorrágico se debía, en parte, a factores tóxicos, fue abandonado y no se volvió a considerar durante varias décadas. En 1934, Blalock describió cuatro categorías de shock: hipovolémico, vasogénico, neurogénico y cardiogénico.
De manera más precisa ¿Qué es el shock?
El shock es el suministro inadecuado de oxígeno y la eliminación de metabolitos potencialmente tóxicos de los tejidos; lo que conduce a disfunción y lesión celular. Puede producirse una hipoperfusión tisular significativa y una lesión celular a pesar de la presión arterial sistémica normal; equiparar el shock con la hipotensión y el colapso cardiovascular es una simplificación excesiva enorme y genera un retraso en el reconocimiento del shock temprano; cuando la intervención es más eficaz para prevenir la disfunción de los órganos diana.
Por lo tanto, comprender la cinética del oxígeno, los principales trastornos fisiológicos que se producen durante el shock, las respuestas del huésped a la mala perfusión y las formas de diagnosticar y revertir los estados de shock pueden mejorar el resultado de los pacientes lesionados y en estado crítico.
Evaluación del paciente con trauma en shock
Las manifestaciones del shock pueden ser dramáticas, como en el paciente con hipotensión profunda; Sin embargo, sus signos pueden ser sutiles y requerir una evaluación e interpretación cuidadosas por parte del equipo de trauma. La evaluación, el diagnóstico y el tratamiento del paciente traumatizado en estado de shock comienzan con los ABC (Vía aérea, respiración, circulación) del examen primario.
En un shock avanzado puede producir un estado comatoso; con pérdida de la capacidad de mantener y proteger las vías respiratorias por lo que es necesaria la intubación endotraqueal. La taquipnea marcada puede estar presente como síntoma de una respuesta homeostática principalmente respiratoria; cuando el sistema respiratorio intenta compensar la acidosis metabólica o en respuesta a la ansiedad generalizada por hipoperfusión del SNC. Durante el examen primario, la circulación se puede examinar rápidamente mediante la evaluación de la presencia y la ubicación del pulso (central frente a periférico), su frecuencia y su carácter.
Este artículo ha sido redactado con base en la información del libro: “Trauma 9a Edición”, de David V. Feliciano, Kenneth Mattox y Ernest Moore.
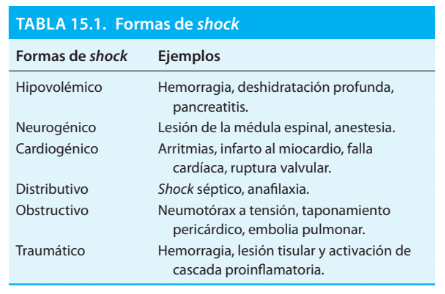
Formas de shock
- Shock hipovolémico: El tipo más común, es el resultado de la pérdida de sangre circulante o sus componentes.
- Shock distributivo o vasogénico: Cómo se observa en la sepsis o la anafilaxia, es el resultado de una disminución de la resistencia al flujo sanguíneo dentro de los vasos de capacitancia del sistema circulatorio, lo que provoca una disminución funcional efectiva del volumen circulante.
- Shock neurogénico: Es una forma de shock vasogénico en la que la lesión de la médula espinal (o anestesia espinal) causa vasodilatación
- Shock cardiogénico: Es el resultado de una falla en la función de la bomba del orazón, como podría suceder con las arritmias o la insuficiencia cardíaca.
Se han agregado 2 categorías adicionales de shock a las propuestas originales de Blalock:
- Shock obstructivo: Se produce cuando el flujo circulatorio está impedido a nivel mecánico (ej: taponamiento pericárdico, neumotórax a tensión, embolia pulmonar)
- Shock traumático: Se observa a menudo en traumatismos multisistémicos con lesiones importantes de tejidos blandos y huesos con o sin hemorragia significativa y se produce como consecuencia de la liberación de «toxinas» de los tejidos lesionados que a menudo son moléculas excluidas, denominadas Patrones Moleculares Asociados al Daño (DAMP) o «señales de peligro» y la regulación positiva secundaria de mediadores proinflamatorios que pueden crear un estado de shock que es mucho más complejo que el shock hemorrágico simple.
Fisiopatología del shock
El shock se produce cuando el suministro de oxígeno, sustratos metabólicos a los tejidos y células y la eliminación de los metabolitos; son insuficientes para mantener el metabolismo aeróbico normal. Este concepto de mala perfusión o hipoperfusión destaca el desequilibrio entre la entrega de sustrato (suministro) y los requisitos de sustrato (demanda) que se produce a nivel celular en los estados de shock.
La hipoperfusión tisular activa una cascada de respuestas cardiovasculares y neuroendocrinas diseñadas para compensar el suministro inadecuado de oxígeno y la eliminación de metabolitos. Las secuelas fisiopatológicas del shock pueden deberse a los efectos directos de la perfusión tisular inadecuada sobre la función celular y tisular o las respuestas excesivas del huésped al estado de shock.
Daños
La magnitud tanto de la agresión como de la respuesta al shock varía según el grado y la duración del mismo. Las consecuencias del shock también pueden variar desde una alteración fisiológica mínima con recuperación completa; hasta una alteración circulatoria profunda, la disfunción de órganos diana y la muerte.
La evidencia acumulada sugiere que, aunque la naturaleza cuantitativa de la respuesta del huésped al shock puede diferir entre las diversas etiologías de este último; la naturaleza cualitativa de la respuesta del huésped al shock es similar sin importar la causa de la agresión. Esta respuesta consiste en cambios profundos en las funciones cardiovasculares, neuroendocrinas e inmunitarias. Además, estas respuestas varían con la genética del huésped, el tiempo y la respuesta a la reanimación. Por ejemplo, en el shock hemorrágico, la compensación inicial por la pérdida de sangre se produce, ante todo, a través de respuestas neuroendocrinas para mantener la perfusión tisular.
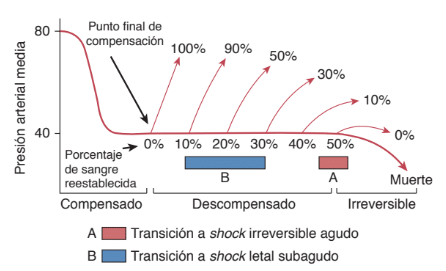
Esto representa la fase compensada del shock. Con la hipoperfusión en curso, la lesión celular empeora y sobreviene la fase descompensada del shock.
La disfunción microcirculatoria, la lesión y la muerte celular y la activación de las células inflamatorias perpetúan la hipoperfusión y pueden exacerbar la lesión tisular. En caso de lograrse la reanimación, la lesión por isquemia o reperfusión puede exacerbar aún más la agresión inicial. La hipoperfusión persistente genera más alteraciones fisiológicas y hemodinámicas y colapso cardiovascular, lo que se ha denominado la fase irreversible de shock. En esta fase, se ha producido una lesión microvascular y parenquimatosa extensa, de modo que la reanimación de volumen adicional no logra revertir el proceso, lo que lleva a la muerte del paciente.
Señales aferentes
Los impulsos aferentes transmitidos desde los lechos de tejidos, se procesan dentro del sistema nervioso central (SNC); activando respuestas efectoras reflejas o impulsos eferentes diseñados para expandir el volumen plasmático, mantener la perfusión periférica y el suministro de oxígeno tisular y reestablecer la homeostasis.
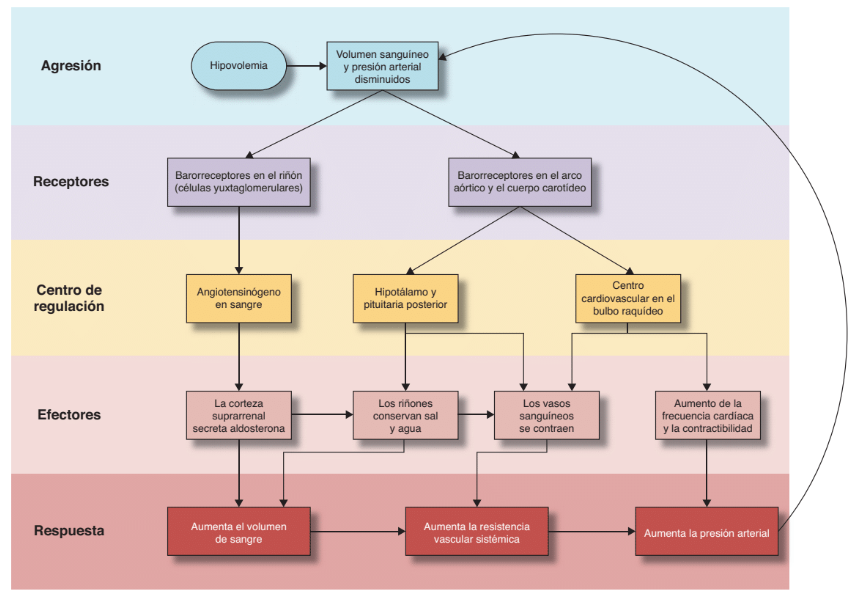
El evento desencadenante inicial suele ser la pérdida de volumen sanguíneo circulante real o relativo. Otros estímulos que pueden producir impulsos aferentes incluyen traumatismo tisular, dolor, hipoxemia, hipercapnia, acidosis, infección, cambio de temperatura, agitación emocional o hipoglucemia.
Señales eferentes
Respuesta cardiovascular
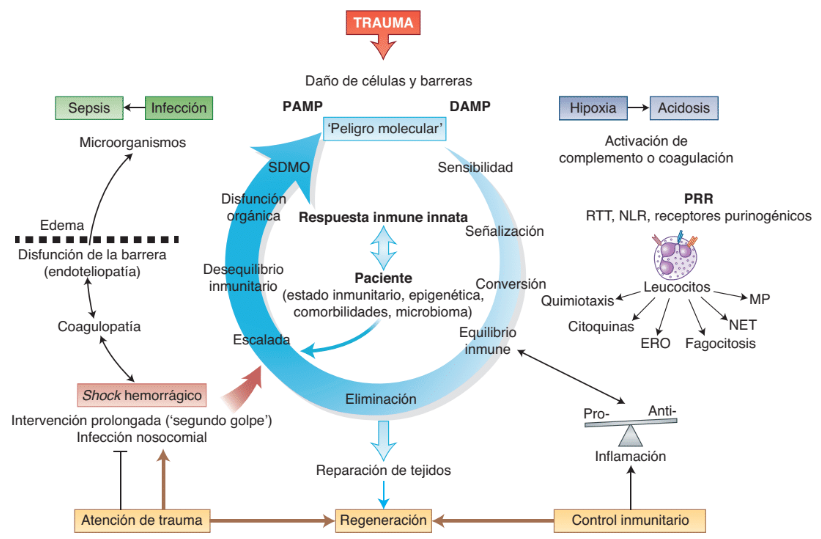
Respuestas inmunes innatas al traumatismo. El trauma conduce al daño de las barreras externas e internas; por lo tanto, expone el sistema inmunitario a patrones moleculares asociados al daño (DAMP) y patrones moleculares asociados al patógeno (PAMP). Las señales de peligro molecular y la destrucción de barreras locales son detectadas por el sistema del complemento y el de coagulación e inducen la señalización intracelular en los leucocitos a través de receptores de reconocimiento de patrones (PRR) lo que conduce a la conversión en una respuesta inmune celular instantánea.
Lo ideal es que una reacción proinflamatoria y antiinflamatoria equilibrada conduzca a una eliminación rápida de los desechos y la inducción de una reparación y regeneración tisular eficaz. Los eventos adversos pueden ser causados por factores individuales del paciente o por; daño tisular agravado después de una hemorragia, una infección nosocomial o una intervención quirúrgica prolongada. La intesificación de la respuesta inmune innata en forma de coágulopatía e inflamación excesiva conduce a alteraciones de la barrera, formación de edemas y defensa innata comprometida contra microorganismos invasores.
Tales cambios pueden agravar las condiciones hipóxicas, la acumulación de metabolitos y la invasión bacteriana; lo cual puede «alimentar» más los DAMP y los PAMP y generar así un círculo vicioso de la respuesta inmune activa. Con el tiempo, esto generará una disfunción orgánica e infección sistémica, lo que enfatiza la importancia de los principios de atención del trauma ajustados al daño, así como el control del equilibrio del sistema inmunitario, en particular en la fase aguda después de la lesión.
Respuesta Neuroendocrina
Una variedad de estímulos aferentes conducen a la activación del eje hipotalámico-pituitario-suprarrenal, un componente integral de la respuesta adaptativa del huésped después del shock. El shock estimula el hipotálamo para que libere la hormona liberadora de corticotropina, lo que resulta en la liberación de la hormona adrenocorticotropina (ACTH) por parte de la hipófisis. En consecuencia, la ACTH estimula la corteza suprarrenal para que libere cortisol; el cortisol actúa de forma sinérgica con la epinefrina y el glucagón para inducir un estado catabólico.
Respuesta inmunitaria e inflamatoria
Las respuestas inflamatorias e inmunitarias innatas son un conjunto complejo de interacciones entre factores solubles circulantes y células que responden a lesiones, infecciones, isquemia y estímulos tóxicos o autoinmunitarios. La función del sistema inmunitario del huésped después del shock está íntimamente relacionada con las alteraciónes en la producción de los mediadores a menudo considerados parte de la respuesta innata del cuerpo a la inflamación localizada, la lesión tisular y la infección.
Respuesta cardiovascular
Las respuestas neuroendocrinas y del SNA al shock dan lugar a cambios en la fisiología cardiovascular, que constituen una característica destacada en las reacciones adaptativas del huésped y en la presentación clínica del paciente en estado de shock. La estimulación de las fibras simpáticas que inervan el corazón activa los receptores adrenérgicos β1 que aumetan tanto la frecuencia cardíaca (cronotropía) como la contractilidad (inotropía) en un intento por aumentar el gasto cardíaco. Sin embargo, se puede producir un aumento del consumo de oxígeno del miocardio como resultado del aumento de la carga de trabajo. Debe lograrse y mantenerse un suministro adecuado de oxígeno al miocardio o se desarrollará isquemia y disfunción miocárdica que exacerbarán el estado de shock.
Efectos celulares
Dependiendo de la magnitud de la agresión y de los mecanismos compensatorios intrínsecos presentes en diferentes células, la respuesta a nivel celular puede ser de adaptación, disfunción y lesión o muerte. La respiración aeróbica de la célula es la vía más susceptible al sumistro inadecuado de oxígeno y a los radicales de oxígeno tóxicos. A medida que disminuye la tensión de oxígeno dentro de las células, la fosforilación oxidativa disminuye y la generación de trifosfato de adenosina (ATP) disminuye o se detiene. La pérdida de ATP, la «moneda energética» celular, tiene efectos generalizados sobre la función, la fisiología y la morfología celulares.
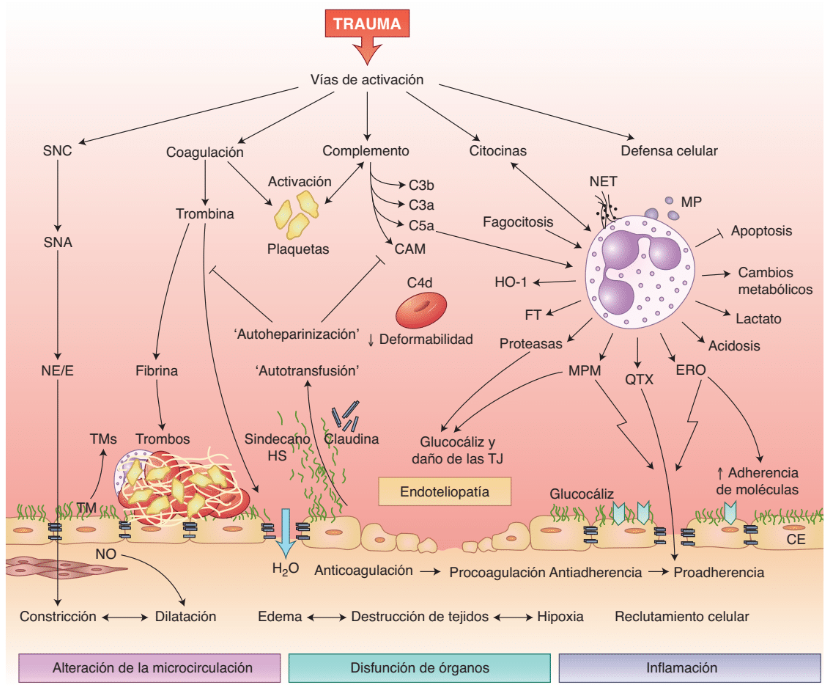
Tras un traumatismo, diversas vías de inmunidad innata pueden inducir endoteliopatía postraumática y más daño tisular. La activación del sistema nervioso autónomo (SNA) y su liberación sistémica de norepinefrina (NE) o epinefrina (E) conduce a una vasoconstrucción instantánea (centralización), activa el endotelio e induce la liberación de trombomodulina (TM), que, de ese modo, disminuye características anticoagulantes del endotelio. La dilatación de las células subendoteliales del músculo liso mediante la estimulación con óxido nítrico (NO) potencia las alteraciones microcirculatorias y la hipoxia.
La escisión de la trombina durante la activación de la cascada de coagulación conduce a la formación de un microtrombo en la superficie endotelial y al debilitamiento de las barreras intercelulares, con salida de agua hacia los tejidos intersticiales. Las plaquetas activadas, junto con los productos de la activación de la coagulación o el complemento y los leucocitos, forman la respuesta tromboinflamatoria. La activación del complemento sobre los glóbulos rojos compromete su deformabilidad.
La activación de leucocitos innatos, en particular granulocitos neutrófilos, por el complemento y las citocinas proinflamatorias; crea un microambiente proinflamatorio general con trampas extracelulares de neurtrófilos (NET) y micropartículas (MP) liberadas; apoptosis reducida y cambios metabólicos que conducen a la generación local de lactato. La generación de especies reactivas de oxígeno (ERO) y metaloproteinasa de matriz (MPM) aumenta la expresión endotelial de moléculas de adhesión y ensancha las uniones célula-célula, lo que facilita la migración de leucocitos al tejido inflamado.
Las proteasas por los leucocitos pueden dañar la capa de glucocáliz y las uniones estrechas (TJ); lo que conduce a la liberación intravascular de glucosaminoflicanos que exhiben efectos osmóticos coloidales y similares a la heparina. (Fig.15.4)